新冠这样的病毒与人类博弈相信不是自今日始。如季节性流感、季节性冠状病毒229E、HKU1等,无不保留了远古以来人类免疫系统与病原体搏斗的痕迹。我们体内现在残留的免疫记忆与免疫屏障虽经数万年,至今仍发挥重要的作用。
近两年我们与新冠的博弈,仍然保留着人类自诞生以来免疫系统与病原体博弈过程中建立的免疫应答模式,但因为疫苗等现代科技的问世,也改变了21世纪人类与病毒博弈的策略。今天的人类希望能够战胜病毒,但不是依靠长期群体免疫与牺牲大量人口建立免疫屏障这一模式。
今天的流行病学、临床医学、分子生物学、免疫学、结构生物学等科学技术的发展,让我们可以在微观和宏观不同维度,直播病毒的变异、人类的反击以及两者博弈的全过程与走向。这种情况在历史上从未发生过,但正是我们现在所亲历的,而随着奥密克戎株的出现,新冠疫情的未来流行趋势似乎变得更加充满不确定性。
今天,国家传染病医学中心(复旦大学附属华山医院)正式在Emerging Microbes& Infections上发表了中国首篇经过同行评议的疫苗加强接种对于奥密克戎株免疫评估的结果。让我们聚焦最新的数据,特别是我们中国自己的和国际的数据,来观察和追踪这场大流行的走向与结局。

图 1|中国首篇经过同行评议的疫苗加强接种对于奥密克戎株免疫评估
奥密克戎毒株确立了主导地位,自然感染与两针疫苗接种无法阻止其传播
这场战争不仅仅存在于病毒与人类之间,还存在于病毒本身之间。奥密克戎变异株诞生之后,即刻与新冠霸主德尔塔变异株展开了进化之战。2021年11月26日,世界卫生组织(WHO)宣布将新变异株 B.1.1.529 命名为“奥密克戎”,并列为受关注变异株(Variant of concern, VOC),即风险等级最高的新冠病毒变异株。不到4周,今天奥密克戎感染已占全美新增新冠感染数字的大约73%,而一周前,该变异毒株感染所占的比例还仅仅是13%左右。在英国大部分地区,奥密克戎变异毒株的感染数量,正在以每48小时内即翻一倍的速度蔓延。
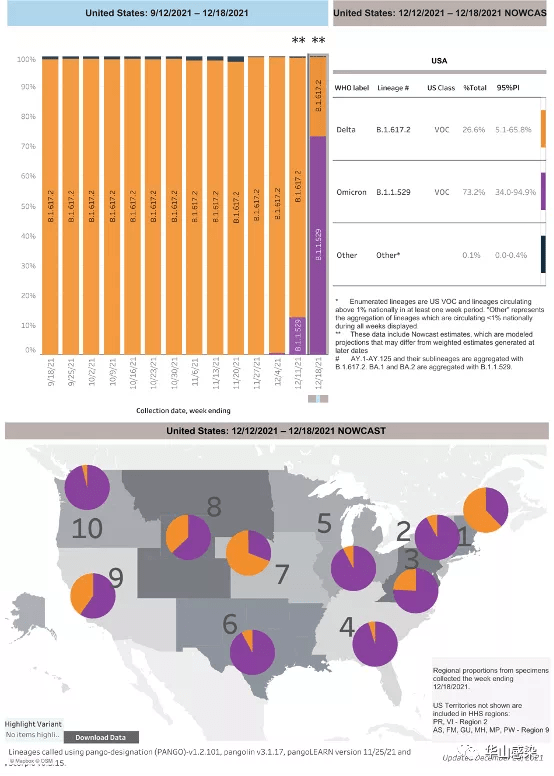
图 2|美国每周新增病例变异株比例及美国各地区变异株比例
这主要基于两个原因。首先是自然感染建立的免疫屏障被奥密克戎跨越。伦敦帝国理工学院近期发表的一项研究显示,奥密克戎变异株发生再感染的风险比德尔塔高出5.4倍,既往感染新冠的患者体内抗体对奥密克戎的保护率可能低至19%。
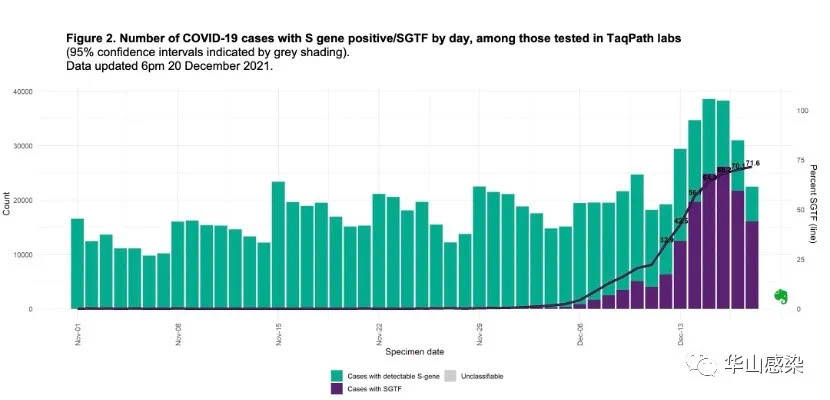
图 3 | 英国新发病例数【绿色为正常病例,紫色为S靶标脱失病例(奥密克戎可能)】
今天我们团队正式发表的数据和国际的数据均证实康复期血清与奥密克戎的中和能力大幅度下降,中国的数据显示奥密克戎较原始株有17.4倍的下降,国际的数据显示奥密克戎较原始株有9—32.8倍的降低。
第二个原因则是,国际研究已经发现,无论哪种疫苗,两针接种后对奥密克戎变异株的保护力发生了显著下降,不能再阻挡疫情的播散。英国和美国的数据已经显示,欧美国家两针疫苗接种率即使高达80%以上,仍然不能阻挡疫情的播散。
我们团队此次研究中发现,两针疫苗针对奥密克戎变异株的抗体滴度下降较为明显,中和抗体滴度下降至6.04,较原始株降低了约10倍。在两针疫苗接种后14天,80%的血清标本对奥密克戎变异株的中和抗体滴度都低于检测下限。这一结论和国外近日多个研究相符。辉瑞的BNT162b2疫苗研究显示,两针后的人体血清对于奥密克戎的中和抗体滴度下降到了6,较原始株降低了约25倍。
这种下降后的抗体水平不足以阻挡变异病毒的传播。但是国际上目前提倡的第三针加强接种是否能够提供保护?中国的第三针接种策略能否构筑足够的免疫屏障?
国家传染病医学中心对三针疫苗(同源与异源接种)接种后血清中和奥密克戎效价进行了评估
国家传染病医学中心(复旦大学附属华山医院)团队近日快速响应,在全球范围内首次评估了两针灭活疫苗接种受试者,第三针同源加强受试者及第三针重组蛋白疫苗异源加强受试者血清对奥密克戎的中和能力。通过中国数据,可以和国际近期的研究进行印证,为应对奥密克戎的未来提供近期的努力方向。
我们此次研究的结果显示,在灭活疫苗同源第三针加强14天后,血清中对疫苗原始株、德尔塔株以及奥密克戎株的中和抗体滴度分别提升到285.6,250.8 和48.73。如果用重组亚单位蛋白苗异源第三针加强14天,血清中对原始株、德尔塔株以及奥密克戎株的中和抗体滴度分别提升到1436, 1501 和95.86。无论是何种类型第三针加强后,血清标本对奥密克戎株的中和抗体滴度阳性率均达到了100%。这意味着三针加强策略可以提供一定程度的保护,但其中,抗体的水平也存在差异。这些研究证实,在两针灭活疫苗的基础上,同源和异源的第三针加强分别将人体对于奥密克戎株的中和能力提升了8.07倍和15.87倍。同时,其对于疫苗原始株的中和抗体滴度也提升了4.24倍和21.31倍,这一结果和团队前不久发表在Cell Research上的研究相符,均提示了第三针加强可以有效提升包括对于原始株和变异株的中和能力。

图 4 |本团队发表在《Cell Research》上的研究。
近期国际数据的发表同样显示,在第三针加强后,中和抗体滴度得到了显著的提升[4]。但是,研究同时提示,相较于其他变异株,奥密克戎株可导致约10倍的抗体滴度降低。德国发表的辉瑞疫苗第三针加强研究发现,辉瑞疫苗第三针加强接种后,血清中奥密克戎株的中和抗体滴度较原始株下降了约6倍。而以色列的一项研究显示,辉瑞疫苗第三针加强接种后,血清中奥密克戎株的中和抗体滴度较原始株下降了约8倍。
综合以上研究显示,加强疫苗接种可部分减少人体奥密克戎株中和抗体水平下降的比例,提升群体对于奥密克戎变异株的保护力。但奥密克戎株相较于其他变异株仍更容易发生逃逸。这预示着未来全面接种第三针后,病毒仍可能会维持一定水平的传播。但第三针疫苗接种策略仍具有显著降低疾病的重症与危重症比例的潜力。根据近期南非与欧美的数据观察,住院率与病死率尚未出现显著升高。
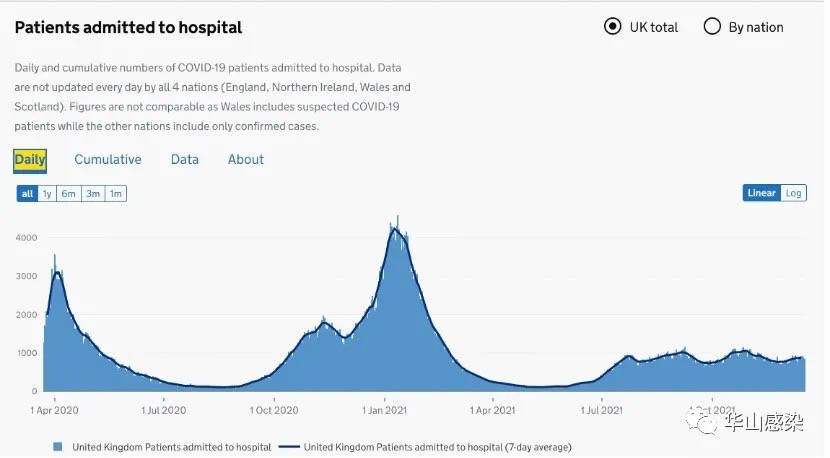
图 5|英国每日住院人数
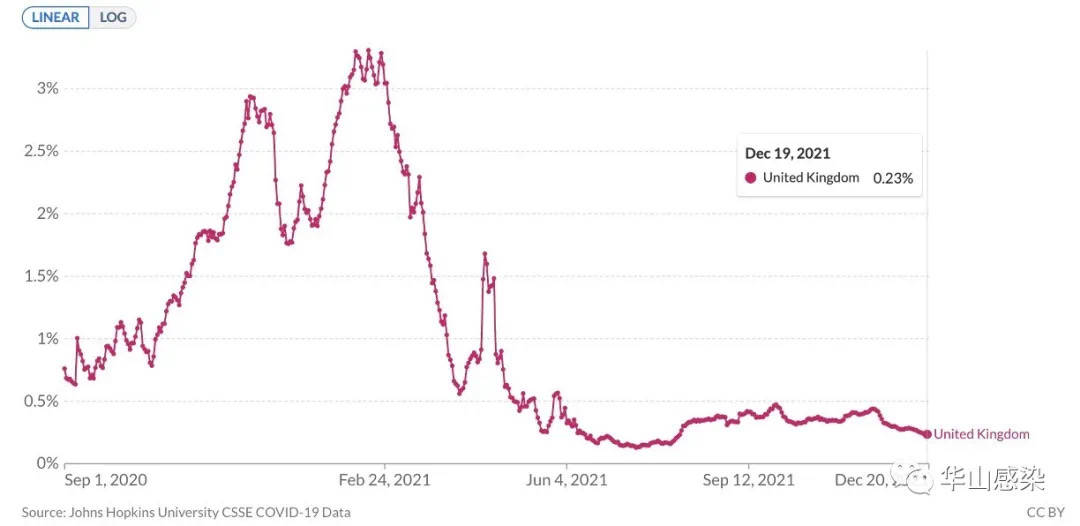
图 6|英国7日平均病死率
展望未来
新冠病毒千变万化,奥密克戎株的出现更是把微生物进化适应生存的能力发挥到极致。但尽管如此,生物进化的底层逻辑没有改变。传染性疾病流行的一个常见现象是感染过的人对病毒会有抵抗力,但是随着抗体的逐渐消失,或者病毒的变异,则可能发生重复感染。奥密克戎的出现透露出新冠病毒演化的规律。尽管我们还不能完全判断这个病毒的进化结局,是更像麻疹水痘,抑或更像普通冠状病毒如 229E,或者更像流感,但是现在看起来它是自成一路。目前的初步数据显示,病毒对于自然感染具有明确的逃避能力,关键的节点可能在于疫苗的强化接种策略在何种程度上与病毒变异会达到平衡,这将决定该疾病在人类社会中进化的未来结局。
基于目前已有的研究数据,我们可以做出如下判断:
疫苗加强接种可以提升免疫屏障,但是不能完全阻挡奥密克戎传播。已有的中国与国际数据均显示了奥密克戎变异株传播速度远高于德尔塔,虽然其致病力可能会略低于德尔塔株,但仍然会在部分病例中引起重症。疫苗强化接种可以部分抵消病毒变异带来的加速传播,但是其保护率仍然较德尔塔病毒有所下降,因此最终的结局可能是即使做了加强疫苗接种,还是不能完全阻挡疾病的传播。但是加强接种很有可能具备降低群体重症化与死亡的能力,当然,这一点还要从后面两周的住院率及病死率上获得更为确切的数据。
目前强化公共卫生与社会措施(PHSM)以及第三针疫苗加强接种是全球能够形成群体对奥密克戎变异株防疫屏障的最好策略。通过时间换空间,通过强化的免疫屏障,降低变异株的致病性。目前,我们应基于全球各个地区各自的疫苗接种现状,尽快推广第三针疫苗加强接种,优化疫苗接种策略,最大程度加快对奥密克戎株免疫屏障的建立。
后续如果病毒进一步变异,不排除可能进入与流感病毒疫苗接种类似的防控策略,通过加大疫苗接种的频度,来应对病毒发生的变异。但是可喜的是,病毒迄今为止,只能不断地依靠抗原漂移来逃避人类建立的免疫屏障(无论是自然感染还是免疫接种)。即便是奥密克戎这种级别的基因变异,往往还是难以彻底逃避人类通过优化免疫策略所构建的高免疫屏障,特别是免疫屏障除了体液免疫之外,还有细胞免疫,以及机体在免疫强度下降后仍然存在的免疫记忆。
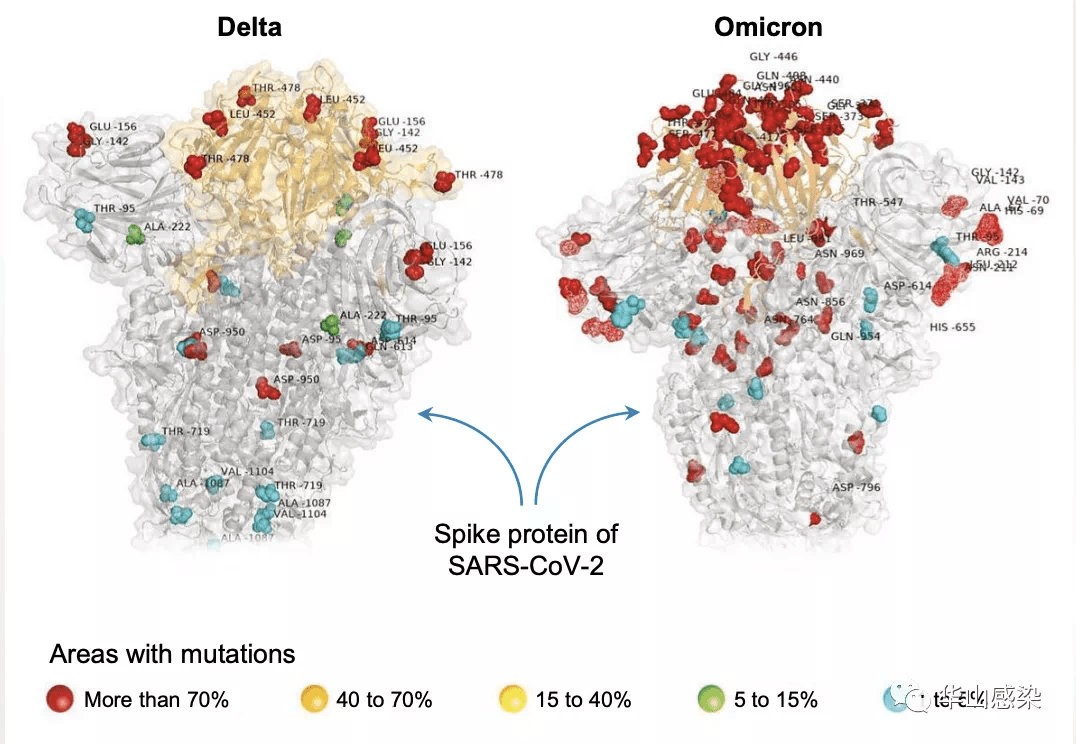
图 7|德尔塔株与奥密克戎株刺突蛋白的S1区域突变比较
总结
奥密克戎变异可能还不是病毒进化的终点,它最终要以什么样的形式生存下来,现在还不知道,可能如英国爱丁堡大学的演化生物学家Andrew Rambaut 所说,“新冠病毒可能还没决定好。”不过,目前看起来,无论是中国的第三针数据,还是国际的第三针数据,至少现在命运还掌握在人类手中。正如世卫组织在2021年12月20日声称的“2022年必须终止新冠大流行”,我们想这句话应该是有底气的。
来源: |